|
شرکت تولیدی فنی مهندسی صنعت تصفیه آب صاف | |||||||||||||||||||||||||||||||||||||||||||||||||||||
|
يکي از عمده ترین مشکلات مربوط به آب سختي آن است که همه ساله ميليونها دلار در جهان صرف نگهداري وتعميرات تجهيزات و لولهكشيهاي آسيب ديده از آن ميشود اين مساله عامل اصلي گشوده شدن زمينه اي بنام سختي گيري و صنايع مربوط به آن شده است.
مکانيزم ايجاد سختي آب بدين صورت است که بخار آب در جو چگاليده شده، دي اکسيد کربن هوا را در خودحل ميکند و تشکيل اسيد ضعيفي بنام اسيد کربنيک ميدهد اين اسيد همراه با قطرات باران به زمين ميبارد.
از خاکهاي سطحي عبور کرده و به بسترهاي سنگي زير زمين که معمولاً سنگ آهک ميباشند مير سد سنگ آهک مخلوطي از کربنات کلسيم و منيزيم ميباشد اسيد ضعيف، آهک را در خود حل ميکند و موجبات سختي آب را فراهم ميآورد.
منيزيم و کلسيم به عنوان عناصر دو قلوي سختي زا شهرت دارند و از آنجايي که از لحاظ خواص به هم نزديک هستند هرچه در باره آنها طرح گردد در باره ديگري نيز صادق است.
سختی آب ناشي از يونهاي کلسيم، منيزيم، باريم، هيدرو کربنات، کلر، سولفات و نيتراتها و آهن و منگنز ميباشد ولي چون غير از ترکيبات کلسيم و منيزيم ساير ترکيبات قابل صرفنظر کردن هستند (بدليل غلظت بسيار کم آنها) بنا براين اصطلاحاً به مجموع کاتيونهاي کلسيم و منيزيم سختي آب ميگويند معمولاً سختي آب به دو قسمت موقت و دائم تقسيم ميشود.
ب- سختي موقت
منظور از سختي موقت يا سختي کربناتي و يا سختي بي کربناتي، املاح بي کربنات کلسيم و منيزيم است که دراثر حرارت دادن از حالت محلول بصورت غير محلول در ميآيد مثلاً بي کربنات کلسيم در آب در اثر حرارت به رسوب کربنات کلسيم تبديل ميشود .
پ- سختي دائم
ت- سختي کل
سختي کل عبارت از مجموع سختي کربناتي و غير کربناتي يعني سختي غير کربناتي+ سختي کربناتي =سختي کل
آب مهمترين سيال در حرارت و برودت است كه وظيفه انتقال گرما در مبدلهاي حرارتي را به عهده دارد .
در برجهاي خنك كن، بويلرها و چيلرها از آب به عنوان مايع مبدل استفاده ميشود بطوريكه گردش آب موجب تبادل حرارتي ميگردد.
معمولا آب استفاده شده در كاربردهاي حرارتي و برودتي از نوع آب سخت (با سختي بيش از 150 ppm) است که توضیحات آن در شرح کامل سختی گیر داده شده است.
آبهاي سخت تشكيل رسوب كربنات كلسيم ميدهند كه مشكلات متعددي را بوجود ميآورد . اين پوسته به شكل رسوب بر روي سطوح داخلي لولههاي حامل آب باعث كاهش ظرفيت انتقال جريان آب و انتقال جريان حرارت ميشود.
يك لايه رسوب به قطر يك ميليمتر بر روي سطوح گرم كننده يك آب گرم كن بصورت عايق حرارتي عمل كرده و در نتيجه تقريباً %10 افزايش هزينه به وجود خواهد آمد.
تشكيل رسوب در جدارها و ديوارها باعث آسيبهاي فراواني به تأسيسات حرارتي و برودتي ميشود كه مهمترين آنها كاهش بازدهي مبدلها و در نتيجه افزايش انرژي راهبردي است .
آناليز شيميايي رسوب نشان ميدهد كه تركيب اصلي تشكيل دهنده كربنات كلسيم، سولفات كلسيم، سولفات باريم، سيليكا و آهن است كه در صد فراواني كربنات كلسيم بيشتر از تركيبات ديگر ميباشد.
در تبديل سختي آب به رسوب و تشكيل آن در سیستمها، سه پارامتر مهم نقش اساسي را ايفا ميكنند. اين عوامل عبارتند از: دما، قلياييت و فشار
1- دماي آب
2- قلياييت آب
با كاهش اسيديته و افزايش قلياييت آب، حلاليت آن نيز كمتر شده كه نتيجه آن افزايش رسوب خواهد بود. نمودارکاهش حلاليت با افزايش قليائيت
3-فشار آب
كاهش فشار آب، كاهش حلاليت را در پي خواهد داشت كه ماحصل آن نيز مانند موارد قبلي، افزايش ميزانرسوبگذاري خواهد بود.
ج- روشهاي مهار املاح و رسوب آب
براي برطرف كردن آثار آب سخت، روش های گوناگونی وجود دارد که مهمترین آنها روش های زیر است:
1- روش تبادل يوني
اگر بخواهيم املاحي را که باعث ايجاد رسوب ميشود( سختي) حذف کنيم از سختي گير استفاده ميکنيم و اگر بخواهيم آب فاقد کليه املاح باشد از ديونايزر استفاده ميکنيم.
رزينهاي موازنه کننده يون، ذرات جامدي هستند که ميتوانند يونهاي نامطلوب در محلول را با همان مقدار اکي والان بر لیتر از يون مطلوب، با بار الکتريکي مشابه جايگزين کنند.
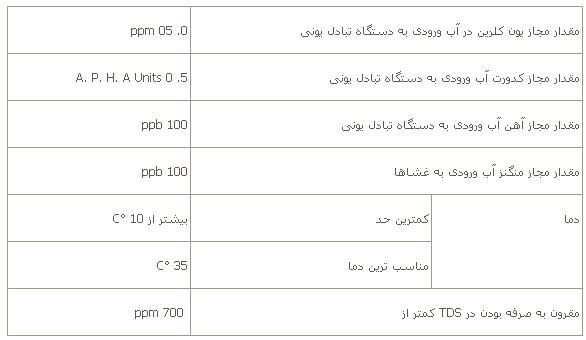
اين روش برای محلولهای با غلظت نسبتاً بالا امكانپذير است ولی از نظر اقتصادی اگر T.D.S آب ورودی (آب خام) کمتر از 700 ppm باشد اين فرايند مقرون به صرفه است.
اين کاتيونهاي متحرک ميتوانند در يک واکنش تعويض يوني شرکت کنند به همين صورت يک تعويض کننده آنيوني داراي نقاط کاتيوني غير متحرکي است که آنيونهاي متحرکي مثل يا به آن متصل ميباشد.
در اثر تعويض يون، کاتيونها يا آنيونهاي موجود در محلول با کاتيونها و آنيونهاي موجود در رزين تعويض ميشود، بگونهاي که هم محلول و هم رزين از نظر الکتريکي خنثي باقي ميماند.
طبقهبندي رزينها
رزينها بر حسب گروه عامل تعويض متصل به پايه پليمري رزين به چهار دسته تقسيم ميشوند:
رزينهاي کاتيوني قوي SAC (Strong acidis Cation)
رزينهاي کاتيوني ضعيف WAC (Weak acids Cation)
رزينهاي آنيوني قوي SBA (Strong basic anion)
رزينهاي آمونيوني ضعيف ( WBA (Weak basic anion
بطور کلي رزينهاي نوع قوي در يک محدوده وسيع PH و رزينهاي نوع ضعيف در يک محدوده کوچک از PH مناسب هستند. وليکن با استفاده از رزينهاي نوع ضعيف، صرفهجويي قابل توجهي در مصرف مواد شيميايي مورد نياز براي احيا رزين را باعث ميشود.
رزينهاي کاتيوني قوي قادر به جذب کليه کاتيونهاي موجود در آب ميباشد ولي نوع ضعيف قادر به جذب کاتيونهاي هستند که به قليائيت آب مرتبط است و محصول سيستم اسيد کربنيک است.
مزيت رزينهاي کاتيوني ضعيف بازدهي بالاي آنها در مقايسه با رزينهاي کاتيوني قوي ميباشد، در نتيجه باعث توليد پساب کمتر در احيا مکرر ميگردد.
اصولا زماني که هدف جداسازي کليه کاتيونها، آب است ،بکارگيري توام رزين کاتيوني قوي و ضعيف اقتصادي تر از بکارگيري رزينهاي کاتيوني قوي ميباشد.
رزينهاي آنيوني قوي قادر به جذب کليه آنيونهاي موجود در آب بوده ولي رزينهاي آنيوني قادر به جذب آنيون اسيدهاي قوي نظير اسيد سولفوريک، کلريدريک و نيتريک ميباشد.
رزينهاي آنيوني ضعيف مقاوم تر از رزينهاي آنيوني قوي بوده و به همين جهت در سيستمهاي تصفيه آب، رزينهاي آنيوني قوي در پاين دست رزينهاي آنيوني ضعيف قرار ميگيرند.
برخي از کاربردهاي رزينها
رزينهاي کاتيوني سديمي ، نه تنها کاتيونهاي سختي آور آب ،بلکه همه يونهاي فلزي را با سديم تعويض ميکنند.
براي احيا اين نوع رزينها کافي است که رزين را با آب نمک شست و شو دهيم تا رزين به فرم اوليه خود برگردد.
با رزينهاي کاتيوني چه نوع هيدروژني و چه نوع سديميميتوان آهن و منگنز را چون بقيه کاتيونها حذف کرد اما به علت امکان آلوده شدن رزينها معمولا مشکلاتي داشته و بايد نکاتي را رعايت کرد.
1- اولا بايد دقت کرد که قبل از حذف يون آهن توسط رزين هيچ هوايي با آب در تماس قرار نگيرد چون در اثر مجاورت
با هوا، آهن و منگنز محلول در اب اکسيده شده و غير محلول در ميآيند و در نتيجه روي ذرات رزين رسوب کرده و باعث آلوده شدن رزين ميگردد.
2- حذف سيليکات از آبهاي صنعتي با استفاده از رزينهاي آنيوني قوی
اگر بخواهيم آب بدون يون داشته باشيم بايد از دي يونايزر استفاده کنيم، بدين منظور از دو و يا چند دستگاه تبادل يوني کاتيوني و آنيوني که بصورت سري قرارگرفته باشند استفاده ميکنيم .
بنابراين مبادله کننده يوني اولي از نوع کاتيون هيدروژني بوده و مبادله کننده يوني دومي از نوع آنيوني هيدروکسيلي ميباشد براي محاسبه واحد تبادل يوني، ابتدائاً باید آناليز آب را داشته باشيم.
به طور کلی برای سیستم تبادل یونی نیاز به چند فاکتور برای محاسبه سیستم سختی گیر است ، و با در نظر گرفتن میزان نیاز از مصرف آب تولیدی، و آب تولیدی جهت مصارف چه کاری مورد استفاده قرار میگیرد را باید در نظر گرفت که متخصص امر، با اعلام موارد فوق سختی گیر مورد نیاز کارفرما را طراحی خواهد کرد.
دي يونايزر
دي يونايزر دستگاهي است شامل يك ستون آنيوني، و آنیونی كه قابليت توليد آب بدون يون با هدايت الكتريكي زير 1ميكروزيمنس را دارا ميباشد.
در ستون كاتيوني كليه كاتيونها شامل كلسيم، منيزيم سديم،پتاسيم ودر ستون آنيوني كليه آنيونها شامل كربنات سولفات، كلرايد نيترات وسيليكات حذف ميگردند.
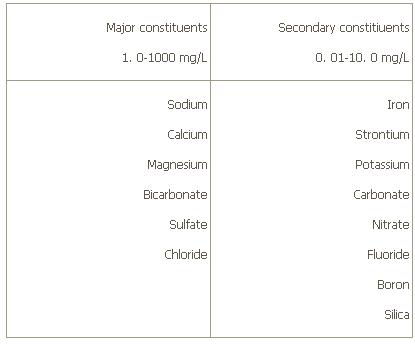
يونهايي که در اکثر سيستمهاي آبي طبيعي در اندازهگيري T.D.S مشاهده ميشود، در جدول زير آورده شده است.
آنهايي که در قسمت اجزاي اصلي ليست شده اند، غالباً براي مشخص کردن ميزان جامدات محلول آب کافي بوده، و اينها يونهاي معمول (Common Ions) ناميده ميشود.
نکات مهم در مورد سيستم تبادل يونی
- برای تصفيه آب نبايد رزينهای آنيونی پيش از کاتيونی قرار گيرد زيرا PH آب خروجی از دستگاه تبادل يونی کاتيونی قليايي بوده و برخی از کاتيونها روی آنيونها رسوب کرده و باعث تخريب رزينها میشوند.
- آب عبوری از ستون تبادل يونی هميشه بايد بدون مواد کلوئيدی و معلق باشد مواد ريز معلق موجب مسدود شدن خلل و فرج رزينها ميشود.
- جهت نگهداری طولانی مدت رزينها و جلو گيری از تخريب و آسيب ديدن آنها در توقفهای طولانی مدت، ميتوان رزين را توسط کلريد سديم اشباع کرد.
- قيمت رزينهای آنيونی به دليل پيچيده بودن فرايند توليد آنها خيلی بيشتر از رزينهای کاتيونی ميباشد.
- به دليل اسيدی و يا قليايي بودن آب درون دستگاههای مبادله کننده يونی کاتيونی و آنيونی، جداره داخلی مخازن بايستی در مقابل اثرات خورندگی آن مقاوم باشد. بنابراين بايستی یا از مخازن فايبر گلاس ويا استنلس استیل برای سیستم هایی که لازم به احیاء توسط اسید می باشد تعبیه گردد و اگر نحوه احیاء با کلرید سدیم می باشد اکتفا به مخازن فولاد کربنی با پوشش درونی اپوکسی یا پوشش درونی پلاستیکی استتار شود.
شایان توجه است بخشی از طراحی و تولید دستگاههای مبادله کننده يونی از سوی این صنایع از جنس F. R. P استفاده ميشود که برای هر ماده شيميايي مناسب است، و مزیت این مخازن در زمان عدم شستشوی رزین ها که به حالت اشباء می مانند و احیاء نمی گردند با اسید قابل احیاء هستند چرا که بستر شستشو برای رزین ها با توجه به نوع مخزن آماده است.
- آب مقطر، آب توليد شده توسط R.O و يا الکترودياليز دارای يون ميباشند برای تهيه آب بدون يون لازم است يک سيستم تبادل يونی به دنبال سيستمهای فوق قرار داده شود.
سختيگير
از آنجاييکه در ديگهاي بخار و آب گرم و آب داغ سختي باعث ايجاد رسوب ميشود پس باید سختي را حذف نمود لذا بدين منظور از سختيگير که هم سختي موقت و هم سختي دائم را حذف ميکنند استفاده ميشود.
در محاسبه و انتخاب يک سختي گير پارامترهاي زير موثرند:
1- دبي آب ورودي به سختي گير
2- سختي آب ورودي
3- نوع و ظرفيت رزين
4- سيکل احياء و شستشو (فاصله زماني بين دو تا احياء رزينها)
از مشخصههاي مهم سختيگيرها، نوع رزين، حجم رزين، ابعاد سختيگير (قطر و ارتفاع) و جنس سختيگير ميباشد.
سازندگان رزينها معمولاً مشخصات کاملي از محصولات توليدي خود را ارائه ميدهند سپس با توجه به فرمول ذیل ظرفيت رزين را بدست آورده سپس حجم رزين را حساب ميکنيم:
M=TH(ppm)×V (gpm) ×T(min)/17.1
R.V=V/R.C
که M مقدار سختي آب (در فاصله دو احياء) به گرين.
R.Vحجم رزين به فوت مکعب.
Thسختي کل ورودي به V .
gpm دبي آب سختي گيري شده به گالن بر دقيقه(آب تغذیه – معمولاً 2% تا4% آب در گردش سیرکولاسبون)
Tزمان بين دو احياء (سيکل احياء به دقيقه معمولاً ضریبی از شبانه روز مثلاً 24 ، 48 و یا 72 ساعت)
R.C ظرفيت رزين بر حسب گرين بر فوت مکعب (معمولاً 30،000 تا 40،000)
دستگاه سختی گیر را به شیوه یی طراحی میکنند که از سطح مقطع (کف نازلها) تا بالا به صورت افقی ایستاده با توجه به تزریق رزین در درون مخزن از سطح رزین تا کف نازل به عمق 24 تا 36 اینچ باشد.
برچسبها: سختی دائم, سختی موقت, سختی کل, سختی اب [ هفتم فروردین ۱۳۹۸ ] [ ] [ گروه رایانه ]
مشخصات فیزیکی آب آشامیدنی
حدمجاز
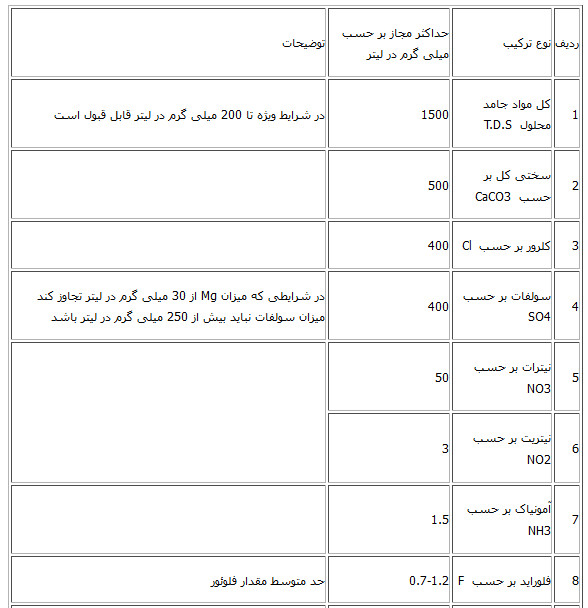
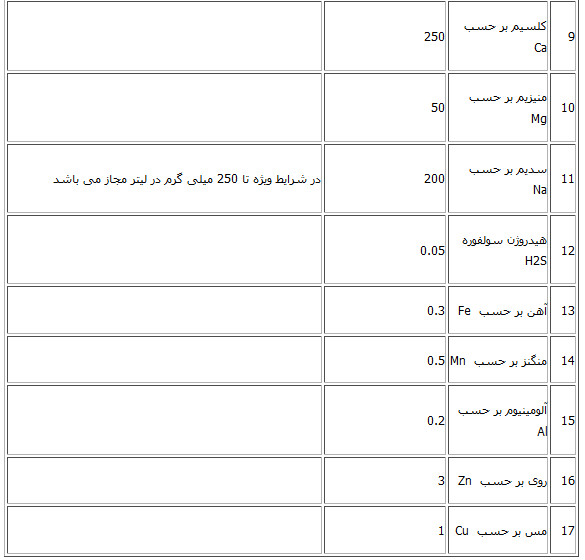
عنوان پارامتر فرمول شیمیایی واحد مجاز 1800 μS EC هدایت الکتریکی 6/5-8/5 - PH Ntu 5 - کدورت 1500 mg/L- تی دی اس 1/4-24 mg/L فلئور 400 mg/L کلرور 400 mg/L So4 سولفات 3 mg/L NO2 نیتریت mg/L برحسب P فسفات نیتراتNO3 50mg/l 250 mg/L Ca کلسیم 50 mg/L Mg منیزیم 200 mg/L Na سدیم 12 mg/L K پتاسیم 0/3 mg/L Fe آهن 0/5 mg/L Mn منگنز 1/5 mg/L NH3 آمونیاک در مواقعی که سولفات بیش از 250 میلی گرم بر لیتر باشد حدمجاز Mg میلی گرم بر لیتر است «حداکثر مجاز مواد شیمیایی کانی موجود در آب آشامیدنی»
منبع: موسسه استاندارد و تحقیقات صنعتی ایران - استاندارد 1053 - ویژگیهای فیزیکی و شیمیایی آب آشامیدنی
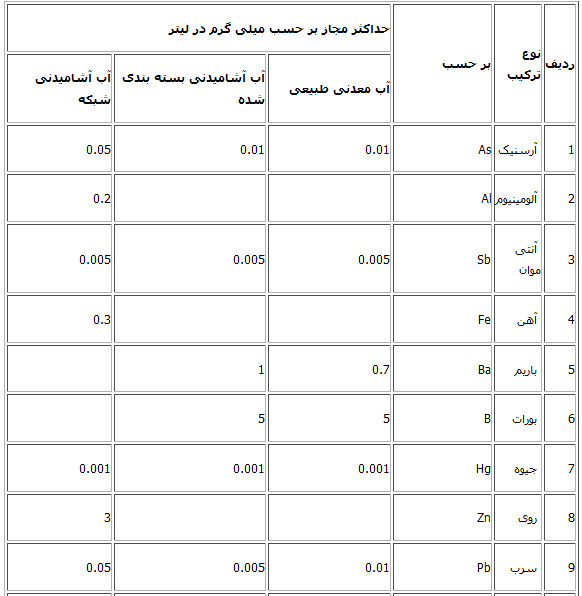
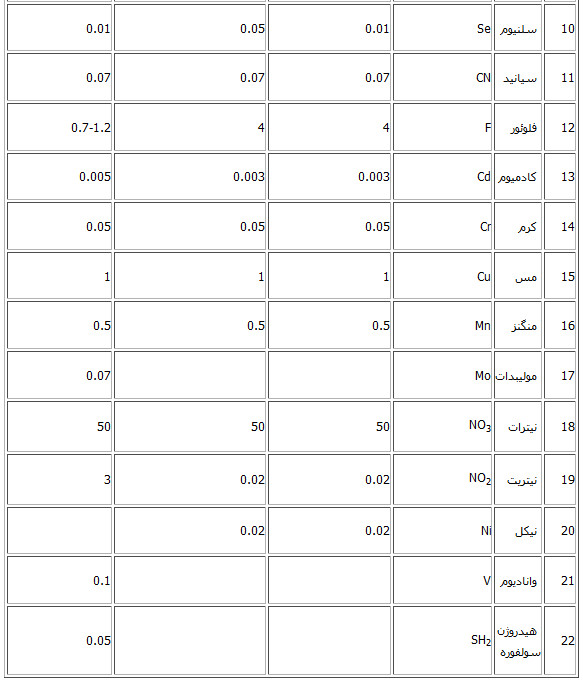
« جدول حداکثر مقادیر مجاز مواد شیمیایی معدنی سمی»
مطابق با استانداردهای ذیل: استاندارد 1053 - ویژگیهای فیزیکی و شیمیایی آب آشامیدنی - چاپ چهارم - تجدید نظر پنجم - سال 1376 استاندارد 2441 - آب معدنی طبیعی - ویژگیها - چاپ اول- سال 1384 استاندارد 6694 - آب آشامیدنی بسته بندی شده - ویژگیها - چاپ اول
حداکثر مقدار مجاز مواد شیمیایی کافی موجود در آب آشامیدنی
یادآوری: نظر به اینکه بین یون منیزیم و سولفات از نظر تغییر طعم و امکان اختلال در جهاز هاضمه وجود دارد از این رو در شرایطی که مقدار منیزیم از 30 میلی گرم در لیتر تجاوز کند مقدار سولفات نباید بیش از 250 گرم در لیتر باشد. 1- Total Dlssolved solids 2- در شرایط ویژه فقدان منبع آب با کیفیت برتر در منطق تا 2000 میلی گرم در لیتر مجاز می باشد. 3- سازمان بهداشت جهانی از دیدگاه بهداشتی حدی برای سختی آب توصیه نکرده است و حد مورد اشاره در این جدول از نظر فنی – مهندسی اقتصادی می باشد. در مورد نیترات و نیتریت- مجموع نسبت غلظت هر کدام به مقادیر توصیه شده نباید از یک تجاوز کند. و نباید به تنهائی مورد قضاوت قرار گیرد. پارامترهای فیزیکی و شیمیایی آب
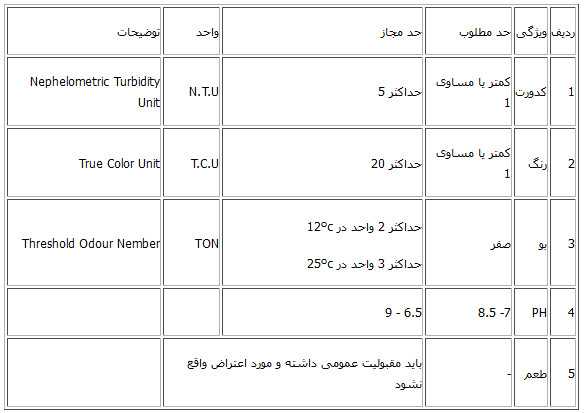
رنگ سنجی رنگ یکی از مشخصه هـای دائمی آب هـای سطحی است. از عـوامل ایجاد کننده رنگ در آب می توان به یون های فلزی (مثل آهن و منگنز) تـرکیبات موجود در پساب های صنعتی، گیـاخـاک ها، پلانکتون ها و… اشاره نمود. برای آنکه آبـی جهت مصارف عمومی و صنعتی مناسب شود، رنگ موجود در آن می بـایست حـذف گردد. وجود رنگ در آب پتانسیل تشکیل تری هلومتان ها را افزایش می دهـد. همچنین رنگ تابع PH بوده و بـا افزایش PH آب شدت رنگ افزایش می یابد و با کاهش PH از شدت رنگ کاسته می شود. رنگ بـه دو صـورت است؛ رنگ ظاهری و رنگ حقیقی. رنگ ظاهری : رنگی است که آب در اثر وجود مواد معلق و ترکیبات محلول رنگین آلـی و معدنی به خود می گیرد. این رنگ برای نمونه اصلی آب قبل از صاف کردن یا سانتریفیوژ تعیین می شود. رنگ حقیقی : رنگی است که پس از عبور نمونه آب از صافی مناسب یا جدا کردن املاح معلق آن مشاهده شود که ناشی از وجود مواد محلول در آب می باشد. در واقع رنگ حقیقی محلولی است که کدورت آن حذف شده است. بـرای تعیین رنـگ بـوسیله روش هـای متداول، قبل از انجـام آزمـایـش، کـدورت بـایـسـتـی حـذف گـردد (پیش تصفیه). حداکثر مـجـاز رنـگ در آب آشـامـیـدنـی TCU 15 می بـاشـد. فرآیندهـایی کـه در حـذف رنـگ مؤثر می باشند شامل اکسیداسیون، انعقاد، فیلتراسیون، جذب سطحی و تبادل یونی می باشد. بو و مزه آب خالص بدون بـو و مـزه می بـاشد؛ وجـود مـواد مختلف و بعضی یـون هـا در آب منجر بـه ایجاد بـو و مزه های نامطبوعی در آب می گردند. برای مثال وجود کلراید در آب مزه شوری، وجود اسید مزه ترش، کلر مایع در آب طعم شیرین، آهـن و منگنز و همچنین منیزیم و پتاسیم طعم تلخی را در آب ایجاد می نمایند. وجود برخی گازهـا مانند هیدروژن سولفاید در آب موجب تغییر بوی آب می شود. اندازه گیری مواد آلـی بـوجود آورنده طعم و بـو بـه کمک روش های کروماتوگرافی گازی و مایع امکان پذیر است.
A = حجم نمونه B = حجم آب رقیق سازی شده حد آستانه بوی آب مطلوب در حدود ۳ می باشد. کدورت سنجی کدورت یا کمبود شفافیت در آب، بـه دلیل وجود مواد معلق یا کلوئیدی در آب آشامیدنی می باشد. کدورت موجب پراکنده شدن و یا جذب نور تابیده بـه آن می شود. برای اندازه گیری میزان کدورت، ابتدا نمونه را کـه داخل بطری می بـاشـد بهم می زنیم تا ذرات آن بصورت معلق در بیایند بعد مقداری مشخص از آب را داخل سـل کدورت سنج می ریزیم و سپس نمونه را توسط دستگاه اسکن می نماییم (واحـد آن NTU می بـاشد). حداکثر مجاز کدورت در آب NTU 5 می باشد و کدورت بیش از ۵ واحد معمولا برای مصرف شرب مناسب نیست. از روش هـای کاهش کدورت در آب می تـوان روش های فیلتراسیون ساده، انعقاد، تـه نشینی، صافی و فیلتراسیون غشایی را نام برد. PH سنجی PH معیـاری بـرای سنجش اسیـدی بـودن یـا قـلـیـایـی بـودن مـحـلـول می بـاشـد. برای آب خالص در دمای ۲۰ درجه سانتیگراد که در آن می باشد و بیانگر حالت خنثی است. هـرچـه PH از ۷ کمتر باشد نشان دهنده بـالا رفتن غلظت یـون H+ و در نتیجه اسیدی بودن محلول است و برعکس، هرچه PH از ۷ بیشتر شود نشانگر بالا رفتن غلظت یون OH– است و قلیایی بودن محلول را نشان می دهد. با توجه به رابطه فوق PH می تواند از صفر تا چهارده تغییر کند؛ همچنین مقدار PH به دما بستگی دارد و با تغییر دما مقدار یونیزه شدن آب تغییر می کند. برای سنجش و اندازه گیری PH آب شرب، ۱۰۰ میلی لیتر آب داخل بشر ریخته و سپس توسط دستگاه PH سنج مقدار آن مشخص می گردد. PH آب قابل شرب در محدوده ۹ – ۵٫۶ می باشد. هدایت سنجی مقدار هدایت الکتریکی آب نشان دهنده میزان وجـود املاح در آب است. بهتریـن روش بـرای تشخیص نمونه آب و فاضلاب، سنجش میزان هـدایـت الکتریکی می بـاشـد زیرا آنیون ها و کاتیون های موجود در فاضلاب بیشتر از آب می باشد. در سنجش هدایت الکتریکی کـه حساس ترین آزمایش می باشد نمونه (بشرCC 100) باید تا زمانی بـا الکترود دستگاه در تماس باشد که عـدد ثابت و دقیقتـری را نشان دهد (واحد آن میکروزیمنس بـر سانتی متر می باشد). نیترات امروزه مهمترین مشکل آب هـای آشـامیدنی شهر هـای بـزرگ کشور مـا، افزایش بی رویـه میزان نیترات آب هـای زیرزمینی می باشد. از آنجا که نیترات ها در آب به صورت محلول وجود دارد، روش های معمول تصفیه آب قادر بـه حذف آن نیستند. مشکل نیترات وقتی بیشتر می شود کـه همراه با آلودگی میکروبی آب باشد. این ماده بدون رنگ و بـدون طعم بـوده و در آب های آشامیدنی بدون آزمایش شیمیایی قابل تشخیص نمی باشد. نیترات ها در دستگاه گوارش انسان تبدیل به نیتریت می شوند. نیترات ها دارای حلالیت زیاد در آب بوده و بدون بـو است و به سختی از آب قابل حذف می باشد. روش های حذف نیترات شامل رقیق سازی، تبادل یون، اسمز معکوس و تقطیر می باشد. بـرای سنجش نیترات بـه ازای هـر ۵۰ میلی لیتر آب نمونه، ۱ سی سی محلول ۱ نرمال HCL توسط پوآر و پیپت برای حذف مواد آلی اضافه می کنیم. سپس توسط پارافیلم دهانه لوله ها را می پوشانیم و بعد با تکان دادن، محلول را همگن می نماییم. درآخـر مقداری آب در داخـل سل دستگاه ریخته و آن را توسط دستگاه اسپکتروفتومتر اسکن می کنیم (حداکثرمجاز نیترات درآب ppm 50 می باشد). طول موج سنجش میزان نیترات در آب آشامیدنی ۲۲۰ الی ۲۷۵ نانو متر می باشد. نیتریت نیتریت هـا بـه دلیل ایجاد بیماری مت هموگلوبینا در انسان حائز اهمیت می باشند. در این بیماری اکسیژن موجود در خون کاهش می یابد و پوست صورت به خصوص اطراف چشم ها تیره می شود. در سنجش نیتریت ۲ سی سی معرف نیتریت به ۵۰ سی سی آب نمونه اضافـه میکنیم و ۲۰ دقیقه زمـان می دهیم تـا کمپلکس رنـگی را تشکیل دهـد (حـداکـثـرمجـاز نیتریت درآب ppm 3 مـی بـاشـد). سپس تـوسـط دستگاه اسپکتروفتومتر اسکن می نماییم. طول موج سنجش میزان نیتریت در آب آشامیدنی ۵۴۳ نانو متر می باشد. فسفات فسفات هـا بـه سـه شکل ارتوفسفاتها، پلی فسفات ها یا فسفات متراکم و فسفات های آلی در طبیعت وجـود دارند کـه می توانند بـصورت محلول، ذرات ریز و درشت یـافـت شـونـد. اشکـال مختلف فسفاتها از منابع متعددی تولید می شوند. میزان کمی از برخی پلی فسفاتها طی فرایند های تصفیه به آب افزوده می شوند. مقادیـر بیشتری از ایـن ترکیبات ممکن است هنگام شستشو وارد منابع آب شوند زیرا این مـواد از اجزاء اصلی بسیاری از پـاک کننده هـای تـجـارتـی هستند. فسفات ها بـطـور گسترده ای در تصفیه آب دیگ های بخـار بـکـار می روند. ارتـو فسفات های مصرفـی در کشاورزی تـحـت عنوان کـودهـای فسفات می توانند بـه دنبال شسته شـدن خاک در اثـر سیلاب ها و ریزش های تر و یا ذوب برف وارد آبهای سطحی شوند. فسفاتهای آلـی اساسأ به وسیله فرایندهای بیولوژکی تشکیل می شوند. ایـن تـرکیبات در اثـر ورود فـضـولات و بـاقیمـانـده مـواد غـذائـی بـه فـاضلاب و همچنین از تـبـدیـل ارتو فسفاتها در فرایند تصفیه بیو لوژیکی تولید می شوند. در سنجش میزان فسفـات، ۱۰۰ سی سی آب نمونه و ۲ سی سی استـانـدارد فسفات را بـا آب مقطر بـه حجم ۱۰۰ میلی لیتر می رسانیم، ۱ قـطـره فـنـل فتالئین و ۴ سی سی شناساگر هپتامولبیدات آمونیوم بـه مـحـلـول اضـافـه می کنیم؛ سپس با افزودن ۱۰ قطره کلرید قلع مدت ۱۰ دقیقه زمان می دهیم تـا به ایجاد کمپلکس رنـگـی کمک کند. اگـر محلول قلیایی باشد رنگ آن صـورتـی می شود، در ایـن صـورت بـا افزودن مقداری اسید رنـگ را حـذف می کنیم تـا محلول خنثی گردد. در نهایت محلول را توسط دستگاه اسپکتروفتومتر اسکن کـرده و عـدد آن را ثبت می نماییم. طول موج سنجش میزان فسفات آب آشامیدنی ۶۹۰ نانومتر می باشد. فلوراید فلوراید عنصری است که به مقدار فراوان در مناطق آتشفشانی و در مقادیر جزئی در بعضی از منابع آب های سطحی و در غلظت هـای زیـاد در منابع آب های زیرزمینی یـافـت می شود. غلظت مـورد نیاز فلوئور در آب آشامیدنی بـه میانگین دما بستگی داشته و با آن رابطه عکس دارد. غلظت های بـالای ۲ میلی گـرم در لیتر فلوراید در آب آشـامـیـدنـی موجب بیماری فلوئوروزیس (لـکـه دار شـدن دندان ها) می شود؛ همچنین گروهی از محققین معتقدند که بیماری های مونگولیسم و سرطان در ارتباط با مقادیر زیـاد فلوئور در آب است و مصرف فلوئوراید به مقدار زیاد (غلظت بالای ۵ میلی گرم در لیتر) منجر به ایجاد بیماری اسکلتال فلوئوروزیس (افزایش ضخامت استخوان ها، لیگمان هـا و تـانـدون ها را در پی دارد) می گردد. کارشناسان میزان فلوئور مورد نیاز برای ممانعت از پوسیدگی و خالدار شدن دندان ها را حدود ۱ میلی گرم در لیتر اعلام نموده اند. در حال حاضر ۳ روش برای حذف فلوراید اضافی از منابع آب وجود دارد که شامل رسوب دهی شیمیایی، تبادل یونی و اسمز معکوس می باشد. در سنجش میزان فلوراید ابتدا ۵۰ سی سی استـانـدارد ۱ میلی گرم در لیتر را بـه ۵۰ میلی لیتر آب نمونه اضـافـه می کنیم. بـه محلول شاهد (رفرنس)، ۱۰ سی سی اسپاندز (Spands) اضافه کـرده و بدون دادن زمـان آن را داخل سل دستگاه می ریزیم سپس توسط دستگاه اسپکتروفتومتر آن را اسکن کـرده و عـدد بدست آمده را ثبت می نماییم. طول موج سنجش مـیـزان فـلـورایـد آب آشامیدنی ۵۸۰ نانومتر بـوده و حداکثر مجـاز فلوراید در آب آشامیدنی ۱٫۵ تا ۰٫۵ میلی گرم در لیتر می باشد. سولفات سولفات هـا ترکیبی از سـولـفـور و اکسیژن بـوده و بـه عنوان بخشی از مـواد معدنی طبیعی در تشکیلات بعضی از خاک ها و سنگ ها یافت می شوند. به مرور زمان این مواد معدنی حل شده و در آب های زیر زمینی رها می شوند. سولفات همانند سایر مواد معدنی دیگر می تواند باعث بروز لایه های فـلـس مانند در لـولـه هـای آب شده و ممکن است موجب طعم نامطلوب در آب و نهایتا بـروز اسهال در انسان شود. همچنین سـولـفـات دارای تاثیر ضد یبوست بـوده و می تواند منجر بـه از دست دادن آب بدن بویژه در کـودکـان بـاشـد. حداکثر مـجـاز سـولفات در آب ۴۰۰ میلی گرم در لیتر می باشد. در سنجش میـزان سـولفات آب آشامیدنی، ابتدا آب نمونه را بـه حجم ۱۰۰ میلی لیتر می رسـانـیـم و سپس ۱۰۰ سی سی محلول شاهد بـا آب مقطر تهیه می نماییم. غلظت ۲۰ میلی گرم در لیتر استاندارد سولفات به حجم ۱۰۰ سی سی تهیه کرده و سپس ۲۰ میلی لیتر بـافـر سـولـفـات (در غلظت بـالای ppm 10 از بـافـر سولفات A و در غلظت پـایین ppm 10 از بافر سولفات B استفاده می کنیم) و ۰٫۵ گرم کلرو باریم ۲ آبـه به آب نمونه و شاهد اضـافـه کـرده و توسط دستگاه شیکر و مگنت آن را بـه مدت ۱ دقیقه هـم می زنیم. در آخـر محلول را داخل سل ریخته و ۵ دقیقه زمان می دهیم تـا ساکن بماند سپس مقدار سولفات را تـوسـط دستگاه اسپکتروفتومتر بـا طـول موج ۴۲۰ نانومتر سنجش می نماییم. آهن آهـن از فلزاتی است کـه بـدن انسان بـه آن نیاز دارد و کمبود آن موجب کم خونی می گردد. اگـر مقدار آن در آب آشامیدنی زیاد باشد موجب لکه دار شدن لباس ها هنگام شستشو گردد. به علت پایین بودن مقدار آهن در آب فقط در تصفیه خانه های آب که به عنوان منعقد کننده افزوده شده است میزان آن سنجش می شود. برای سنجش آهن موجود در آب آشامیدنی، ۵۰ سی سی آب نمونه و ۵۰ سی سی آب مقطر به عنوان شاهد برداشته و بـه آنها ۱ سی سی استاندارد آهـن ۱۰ میلی گرم در لیتر می افزاییم؛ ۲ سی سی HCl 37% و ۱ سی سی هیدروکسیل آمیـن اضافه کرده و آن را می جـوشانیم (توسط اتوکلاو در دمای ۱۲۲ درجه سانتیگراد بـه مدت ۱۵ دقیقه) تـا پلی فـسـفـات هـا بـه اورتوفسفات هـا تبدیل شوند و سیانید و نیتریت حـذف گـردد. بعد از سـرد شـدن ۱۰ سی سی استات آمونیوم و ۴ سی سی فنانترولین اضافـه کـرده و ۱۰ دقیقه زمـان می دهیم. سپس تـوسـط دستگاه اسپکتروفتومتر میزان آن را سنجش می نماییم. آهن و منگنز از علل تلخی آب آشامیدنی به شمار می روند. آلومینیوم آلومینیوم یک عنصر فلزی فراوان و به اشکال مختلف در طبیعت وجود دارد؛ به شکل ترکیب با انواع مواد آلی و مواد غیر آلـی می باشد که اغلب به صورت محلول هستند. استفاده از نمک هـای آلومینیوم به عنوان منعقد کننده ها در تصفیه آب ممکن است بـاعـث افزایش غلظت آن در آب خـروجـی و منجر به ایجاد رنگ و کدورت نامطلوب در آب شود. غلظت آلومینیوم در آب به میزان بالاتـر از ۰٫۱ میلی گرم در لیتر ممکن است یک فاکتور خطر بـرای ابتلا بـه بیماری آلزایمر باشد. نگهداری PH آب آشامیدنی در حـدود ۹٫۷ می تـوانـد میزان ابتلاء بـه بیماری آلـزایمر را بـه میزان ۵۰% کاهش دهد. این را هم باید اضافه کنیم که سولفات آلومینیوم برای شفاف و قابل آشامیدن شدن، آب به آن اضافه میشود. حداکثر مجاز آلومینیوم در آب آشامیدنی ۰٫۱ می باشد. برای سنجش میزان آلومینیوم در آب، بوسیله بالن ۵۰ میلی لیتری بـه ۲۵ میلی لیتر آب نمونه و شاهد بـه تـرتیب ۱ سی سی اسید سولفوریک ۰٫۰۲ نرمال، ۱ سی سی اسید آسکوربیک، ۱۰ سی سی بـافر آلومینیومی و ۴ سی سی اِریوکروم سیانین اضافه کرده و بعد با آب مقطر آنها را به حجم ۵۰ میلی لیتر می رسانیم؛ سپس بـه مـدت ۷ دقیقه زمان می دهیم و در آخر توسط دستگاه اسپکتروفتومتر مقدار آن را سنجش می نماییم. منگنز منگنز بیشتر در آبهای آهن دار بـا دامنه ای کـمـتـر از آهـن وجـود دارد و روش حـذف آهـن بـر منگنز نیز تـأثیر می گذارد. منگنز بیشتر در آبها وجود داشته و معمولاً مقدارش بیشتر از نمی باشد. این عنصر، مانندآهن از محلول راسب می شـود و بـه فـرم هیدروکسید منگنز قهوه ای یا سیاه رنگ در درون لـولـه هـای انتقال، شیرهـا و غیره دیـده می شود حضور منگنز تولید یک سری لکه هـای بـد رنـگ می کند. بـرای سنجش میزان منگنز در آب آشامیدنی از دستگاهی بـه نـام پـولارو گـرافـی استفاده می شـود و حـداکـثـر مـجـازی کـه بـرای آن تعیین شده، ۰٫۴ میلی گرم در لیتر می باشد. CO2 زمانی که PH آب پایین تر از ۶٫۵ باشد به این معناست که مقدار کربن دی اکسید محلول در آب بیشتر است ولـی اگر PH بالاتر از ۶٫۵ باشد میزان این ماده در آب کمتر می باشد. برای سنجش میزان CO2 در آب آشامیدنی، بـه ۱۰۰ میلی لیتر از آب نمونه ۵ الی ۷ قطره فنل فتالئین، بـر حسب میزان PH، سود ۰٫۱ یا ۰٫۰۲ نرمال به آب اضافه می کنیم تا رنگ آب از سفید به صورتی تغییر رنگ دهد. سپس محاسبات زیر را انجام می دهیم : سیلیس سیلیس بـه اشکال مختلف در آب یافت می شـود و حاصل از تجزیه سنگهای مختلف سیلیسی مانند کوارتز و سنگ سیاه است . سیلیس اغلب برای انسان خطرناک نیست ولی برای صنایع اغلب مشکل ساز است.
برچسبها: آزمایش, توتال, سختی کل, Th [ بیست و هشتم مرداد ۱۳۹۴ ] [ ] [ گروه رایانه ]
روابط عمومي شركت توليدي فني مهندسي صنعت تصفیه آب صاف |
|||||||||||||||||||||||||||||||||||||||||||||||||||||


 است، ۷=PH
است، ۷=PH
